Автор: Михаил Иоелович, профессор, д.х.н., Израиль.
Существование и дальнейшее развитие современной цивилизации требует расширенного производства и потребления энергии. В настоящее время основными источниками энергии являются ископаемые источники топлива – уголь, сланцы, нефть и природный газ. Из нефти и сланцев, как известно, путем ректификации получают углеводородные виды жидкого топлива – бензин, керосин, дизельное топливо и мазут. Пропановые и бутановые фракции природного, нефтяного и сланцевого газа после сжижения также используются в качестве моторного топлива, а также для бытовых нужд. Небольшое количество тепловой энергии получают путем сжигания отходов полиолефенов и некоторых других полимеров, синтезируемых из углеводородов. Известно, что за счет ископаемых видов топлива удовлетворяются до 80% мировой потребности в энергии. Однако, эти источники не возобнавляются в природе и их запасы постепенно истощаются.
С целью снижения дефицита энергии и обеспечения устойчивого развития цивилизации все большее внимание уделяется производству биотоплива из растительной биомассы – твердого (дрова, отходы древесины, бумаги и картона, древесный уголь, топливные брикеты и др.), жидкого (биоэтанол, биодизельное топливо и др.) и газообразного (биогазы). Значительным преимуществом биотоплива по сравнению с ископаемыми источниками энергии является то, что сырьем для его производства является биомасса растений, которая постоянно возобновляется в природе, благодаря фотобиосинтезу. В настоящее время доля биотоплива в мировой энергетике достигает 12-13% и лишь 7-8% приходятся на остальные источники энергии такие как гидроэлектрические, солнечные, ветровые и атомные станции.
Учитывая, что свыше 90% мировой энергетики составляет тепловая энергия, возникает вопрос, каким образом определяют энергетический потенциал различных видов топлива. Эспериментально измерение тепловой энергии осуществляют путем сжигания небольших образцов обезвоженного вещества в специальном устройстве – массивной калориметрической бомбе, заполненной кислородом под давлением. При этом измеряют небольшое повышение температуры (ΔT) с точностью до 0.001 градуса. Зная удельную теплоемкость бомбы (cp), расчитывают эффективную энергию сгорания по уравнению:
ур.(1) U = cp ΔT
Затем в экспериментально полученное значение теплоты вносят поправки на вклад теплоты поджигания (р1), энтальпию образования кислот (р2) – азотной кислоты из остаточного азота в кислороде и азота в образце, серной кислоты из серы в образце и др., теплоту растворения кислот (р3). Кроме того, по количеству образовавшегося CO2 изучают полноту сгорания образца. Приводят теплоту к нормальным условиям, 25оС и 1 атм (Uo), после чего рассчитывают энтальпию или высшую удельную энергию сгорания:
ур. (2) Q = [Uo – (р1+ р2 + р3)]/m
где m – сгораемая масса образца с образованием CO2.
Высшая энергия сгорания включает теплоту конденсации воды, образующейся при сгорании топлива. На практике обычно имеет место случай, когда вода испаряется; тогда измеряют так называемую низшую или чистую энергию сгорания (q), которая связана с высшей энергией (Q) следующими соотношениями:
ур. (3) q (MJ/kg) = Q (MJ/kg) — 0.22 H или ур. (4) q (MJ/kg) = Q (MJ/kg) — 22 (h/M)
где H – процентное содержание водорода в веществе; h — число атомов водорода в молекуле вещества с молекулярной массой М.
Калориметрическая бомба сложное, дорогостоящее и не всегда доступное устройство. Кроме того, измерение теплоты сгорания требует длительных и многократных повторений для получения надежного результата. Поэтому, начиная с работ конца 19 века и до настоящего времени, проводятся многочисленные исследования для разработки расчетных экспресс-методов для определения энергии сгорания различных топлив — органических веществ и материалов.
Д.И. Менделеев [1] в конце 19 века одним из первых предложил уравнение для расчета чистой энергии сгорания некоторых твердых и жидких топлив, основанное на определении процентного содержания углерода (С), водорода (Н) и кислорода (О) в топливе или органическом веществе:
ур. (5) q (MJ/kg) = 0.339 C + 1.035 H — 0.109 O
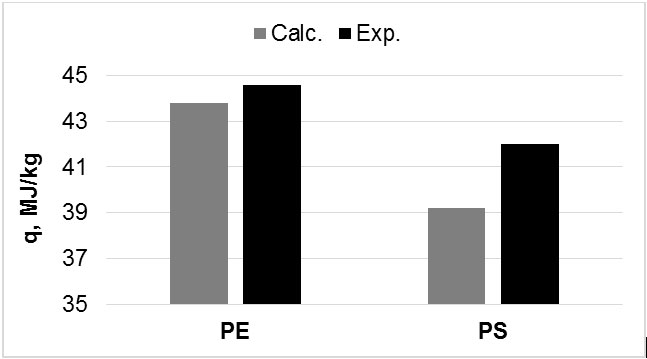
Это уравнение оказалось настолько удачным, что им продолжают широко пользоваться и в настоящее время для предварительной оценки энергии сгорания углеводородов, спиртов, торфа, древесины, биомассы и других топлив. Рассчитаем, например, чистую теплоту сгорания основной фракции бензина — изооктана (C8H18) с молекулярной массой 114. Из приведенной формулы изооктана следует, что топливо содержит 84.2% углерода и 15.8% водорода. Подставляя эти значения в ур. (5) находим, что расчетное значение q = 44.9 MJ/kg, что отклоняется от экспериментального значения тепловой энергии не более, чем на 1%. Незначительное расхождение между расчетами и экспериментом было найдено и при изучении энергии сгорания твердых отходов полиэтилена (Рис.1).
Рис.1. Расчетные (Calc.) и экспериментальные (Exp.) энергии сгорания отходов полиэтилена (PE) и полистирола (PS)
Однако более детальные исследования по применению уравнения Менделеева для большого числа различных веществ показали, что среднее относительное отклонение расчетов от экспериментов все же довольно существенное и составляет 3%, а иногда и выше. Так, расчетное количество теплоты, которое можно получить при уничтожении сжиганием твердых отходов полиэтилентерефталата (PET), например, бутылок для напитков, было ниже действительной тепловой энергии сгорания на 5%, а расчетная энергия сгорания отходов полистирола (PS) была ниже экспериментального значения более чем на 6% (Рис. 1).
Дальнейшие усилия исследователей были направлены на улучшение методики Менделеева с учетом вклада дополнительных элементов таких как сера (S) и азот (N). Характерным примером развития расчетного метода Менделеева является работа Париха с соавторами [2], которые предложили следующее расширенное уравнение:
ур. (6) q (MJ/kg) = 0.349 C + 0.98 H + 0.10 S – 0.10 O – 0.015 N
где C, H, S, O и N – процентное содержание соответствующих элементов в образце.
Например, для серосодержащего вещества полисульфона (C27H22O4S) расчеты по ур. Менделеева дали значение на 4% ниже действительного значения энергии сгорания (29.6 MJ/kg), в то время как расчеты по ур.(6) дают значение совпадающее с экспериментальным. При сжигании шерсти, содержащей все пять элементов C, H, O, N и S, экспериментально получают 23.1 MJ/kg тепловой энергии, что подтверждается расчетами по ур.(6). Хотя уравнение Париха расширило возможности расчетных методов для определения тепловой энергии сгорания веществ и топлив с разнообразным химическим составом, в некоторых случаях, например для PS, оно дает завышенное расхождение с экспериментальными данными порядка 5%.
Простой расчетный метод предложили исследователи из Национальной Лаборатории Возобновляемой Энергии США [3]. Они разработали следующую матрицу вкладов отдельных структурных групп в энергию сгорания органического вещества или полимера (Табл. 1):
Табл. 1. Вклад (Qi) структурной группы вещества в высшую теплоту сгорания [3]
| Группа | Qi, kJ/mole | Группа | Qi, kJ/mole |
| -CH3 | 775 | -COO- | 112 |
| -CH2— | 670 | -C=O | 259 |
| -CH- | 518 | -NH- | 77 |
| -C- | 431 | -O- | -132 |
| -H | 190 | -OH | -108 |
Высшую энергию сгорания рассчитывают по уравнению:
ур. (7) Q (MJ/kg) = M-1 Σ ni Qi
где М – молекулярная масса молекулы вещества или звена полимера; ni — число групп в молекуле или звене полимера.
Затем находят чистую энергию сгорания по ур. (3) или (4).
Табл. 2. Расчетные и экспериментальные значения энергий сгорания
| Образец | Расчет | Эксперимент | ||
| Q, MJ/kg | q, MJ/kg | Q, MJ/kg | q, MJ/kg | |
| Изооктан | 48.2 | 44.7 | 48.0 | 44.5 |
| Этанол | 29.1 | 26.2 | 30.0 | 27.1 |
| Стеарин | 41.0 | 38.2 | 39.7 | 37.5 |
| Полиэтилен (PE) | 47.8 | 44.7 | 47.7 | 44.6 |
| Целлюлоза | 16.4 | 15.0 | 17.4 | 16.0 |
Метод структурных групп можно проиллюстрировать некоторыми примерами (Табл. 2), из которых следует, что этот метод является простым и удобным для предварительной оценки энергий сгорания с точностью 3% и выше.
В результате изучения процесса сжигания различных органических веществ и полимеров ряд исследователей [3, 4] пришли к заключению, что энергия сгорания однотипных веществ определяется числом молей кислорода no расходуемых для полного сжигания 1 моля органического вещества:
СcHhOoSsNn + no O2 = c CO2 + (h/2)H2O + s SO2 + (n/2) N2
где no = с + s + 0.25 h – 0.5 o; с, h, o, s число соответствующих атомов в молекуле вещества.
Была высказана гипотеза, что энергия Eq приходящаяся на 1 моль О2 которая выделяется при сжигании однотипных веществ, является величиной постоянной. Тогда чистую энергию сгорания вещества можно расчитать по уравнениям (8) или (9)
ур.(8): q (MJ/kg) = M-1 Eq no
ур.(9): q (MJ/kg) = M-1 Eq (с + s + 0.25 h – 0.5 o)
Проверка этой гипотезы показало, что для узкого класса однотипных веществ условие приблизительного постоянства Eq выполняется. Например, для ряда синтетических полимеров таких как полиэтилен, полипропилен, полиметилметакрилат, поликарбонат и др. значение Eq составляет в среднем 418 kJ/mole O2 [3, 4]. Однако изучение большой выборки других полимеров и органических веществ показало значительное отклонение Eq от этого значения. Так, для полистирола и полиимида было найдено значение Eq = 440 kJ/mole O2; для биополимеров растений Eq = 433 kJ/mole O2, для различных углеводородов от пентана до декана Eq = 406 kJ/mole O2, для спиртов от метанола до бутанола Eq = 357 kJ/mole O2. Для всей изученной выборки веществ и полимеров было установлено среднее значение Eq = 410 kJ/mole O2 с большим стандартным отклонением, составляющим ±25 kJ/mole O2, или относительным отклонением ±6%. Таким образом, привлекательная гипотеза о постоянстве Eq не выполняется, и поэтому от простого метода расчета энергии сгорания по уравнению (8) или (9) приходится отказаться.
Для совершенствования расчетных методов наиболее перспективным оказалось проведение уточнения и оптимизации коэффициентов корреляционных уравнений типа (5) и (6), связывающих энергию сгорания с элементным составом вещества. Конечным результатом исследовательской работы на данный момент являются уравнения (10) и (11), позволяющие уменьшить расхождение расчетных и эксперименальны данных до 1-2% (см. например Табл.3)
ур. (10) q (MJ/kg) = 0.344 C + H + 0.105 S – 0.110 O – 0.015 N
ур. (11) q (MJ/kg) = 413 M-1 (c + 0.24 h + 0.81 s – 0.43 o – 0.05 n)
где C, H, O, S и N – процентное содержание соответствующих элементов; с, h, o, s число соответствующих атомов в молекуле вещества.
Для использования этих уравнений необходимо из формулы вещества или звена полимера найти число атомов или процентное содержание элементов. Результаты расчетов для некоторых веществ и полимеров показаны в Табл. 3.
Табл. 3. Расчетные (calc.) и экспериментальные (exp.) значения энергий сгорания
| Образец | Формула | M | q calc., MJ/kg | q exp., MJ/kg |
| Углеводороды | ||||
| Гексан | C6H14 | 86 | 44.9 | 44.8 |
| Гептан | C7H16 | 100 | 44.7 | 44.7 |
| Октан | C8H18 | 114 | 44.6 | 44.2 |
| Изооктан | C8H18 | 114 | 44.6 | 44.5 |
| Декан | C10H22 | 142 | 44.4 | 44.3 |
| Бензол | C6H6 | 78 | 39.4 | 40.0 |
| Толуол | C7H8 | 92 | 40.0 | 40.5 |
| Спирты | ||||
| Метанол | CH2O | 32 | 19.7 | 20.0 |
| Этанол | C2H6O | 46 | 27.0 | 27.1 |
| Пропанол | C3H8O | 60 | 30.9 | 31 |
| Бутанол | C4H10O | 74 | 33.8 | 34 |
| Гидрофобные вещества | ||||
| Стеарин | C18H36O2 | 284 | 37.7 | 37.5 |
| *АВА | C20H30O2 | 302 | 36.3 | 36.1 |
| Воск | C36H70O5 | 582 | 36.0 | 36.2 |
| Парафин | C31H64 | 436 | 43.9 | 44.0 |
| Синтетические полимеры | ||||
| Полиэтилен (PE) | -CH2— | 14 | 44.0 | 44.6 |
| Полипропилен (PP) | C3H6— | 42 | 44.0 | 44.6 |
| PMMA | -C5H8O2— | 100 | 25.0 | 25.1 |
| Полистирол (PS) | -C8H8— | 104 | 39.4 | 40.0 |
| *PET | -C10H8O4— | 192 | 21.9 | 22.0 |
| Биополимеры | ||||
| Ксилан | C5H8O4 | 132 | 16.3 | 16.5 |
| Целлюлоза | C6H10O5 | 162 | 16.0 | 16.0 |
| Маннан | C6H10O5 | 162 | 16.0 | 16.1 |
| *Лигнин-х | C10H11O3 | 179 | 26.2 | 26.5 |
| *Лигнин-л | C11H12O4 | 208 | 24.1 | 24.5 |
| Протеины | C5H8O1.5N1.3S0.1 | 113 | 23.3 | 22.8 |
*АВА – абиетиновая смоляная кислота; PET – полиэтилентерефталат; Лигнин-х это лигнин древесины хвойных пород; Лигнин-л это лигнин древесины лиственных пород или травянистых растений
Табл. 4. Чистая энергия сгорания типичных топлив (расчетная)
| Топливо | Формула | M | q, MJ/kg |
| Пропан (ж) | C3H8 | 44 | 46.2 |
| Бутан (ж) | C4H10 | 58 | 45.6 |
| Бензин | C8H18 | 114 | 44.6 |
| Киросин | C12H26 | 170 | 44.3 |
| Дизельное топливо | C12H23 | 167 | 43.3 |
| Мазут | C50H102 | 702 | 43.8 |
| Растительное масло | C18H34O2 | 282 | 37.3 |
| Биодизельное топливо | C19H36O2 | 296 | 37.6 |
| Метанол | CH2O | 32 | 19.7 |
| Этанол | C2H6O | 46 | 27.0 |
| Уголь (углерод) | С | 12 | 34.4 |
Как следует из представленных результатов (Табл. 3 и 4), углеводороды характеризуются наиболее высоким энергетическим потенциалом, и поэтому именно вещества этого класса используются в качестве моторного топлива и горючего для генерации тепловой энергии. По своим энергетическим свойствам все виды углеводородного топлива (от пропан/бутана до мазута) превосходят чистый уголь, масла и спирты.
Однако при сгорании 1 тонны углеводородного топлива в атмосферу выделяется 3.1 тонны углекислого газа, что обостряет проблему «парникового» эффекта и изменения климата. С целью снижения накопления углекислого газа в США, Бразилии, Европе, Японии и ряде других стран начали производить смешанное моторное топливо – бензин с добавкой биоэтанола (биотехнологического этанола) и дизельное топливо с добавкой биодизеля (сложного эфира жирных кислот и метанола), хотя биодобавка несколько снижает теплотворную способность. При этом происходит экономия невоспроизводимого в природе углеводородного топлива. Поскольку при сгорании биоэтанола и биодизеля выделяется на 37-40% меньше углекислого газа, чем при сгорании углеводородов, есть надежда, что использование смешанного топлива в течение длительного времени сможет улучшить состояние климата.
Сама биомасса растений, из которой получают жидкое биотопливо (биоэтанол и биодизель), является неограниченным воспроизводимым источником тепловой энергии. Известно, что основное население мира живет в недостаточно развитых и развивающихся странах. Для обогрева и приготовления пищи жители этих стран используют в качестве топлива дрова и отходы растительной биомассы – стружки, опилки ветки, солому и т.п. Во многих странах доля топлива из растительной биомассы составляет более 90% потребления энергии для бытовых нужд. В промышленно развитых странах отходы биомассы специально сжигают для их уничтожения и получения дополнительной энергии.
По элементному составу (Табл. 5) с помощью ур.(10), можно расчитать энергию сгорания природных материалов, используемых в качестве твердого топлива, таких как торф, бурый уголь и древесина. Другой метод расчета основан на изучении композиционного состава природных материалов (Табл. 6), зная который и энергию сгорания отдельных компонентов – целлюлозы, гемицеллюлоз, лигнина, протеинов, восков (Табл. 3), можно легко рассчитать энергию сгорания самого растительного материала по уравнению:
ур. (12) q (MJ/kg) = Σ wi qi
где wi – масовая доля компонента в материале; qi — энергия сгорания компонента.
Табл. 5. Типичный элементный состав сухих природных материалов и их расчетная энергия сгорания
| Образец | C, % | H, % | O, % | N, % | S, % | Ash, % | q, MJ/kg |
| Торф | 49.1 | 5.3 | 31.0 | 1.8 | 0.8 | 12 | 18.8 |
| Бурый уголь | 53.6 | 3.4 | 27.2 | 0.6 | 0.2 | 15 | 18.8 |
| Древесина ели | 51.6 | 6.2 | 41.1 | 0.1 | 0 | 1 | 19.4 |
| Древесина тополя | 49.3 | 6.3 | 43.3 | 0.1 | 0 | 1 | 18.5 |
Табл. 6. Типичный композиционный состав (масс. доли) сухих природных материалов и их расчетная энергия сгорания*
| Образец | Цел. | Геми. | Лигн. | Прот. | Экст. | Зол. | q, MJ/kg |
| Древесина сосны | 0.48 | 0.19 | 0.27 | 0.01 | 0.04 | 0.01 | 19.5 |
| Древесина ели | 0.47 | 0.20 | 0.28 | 0.01 | 0.03 | 0.01 | 19.4 |
| Древесина тополя | 0.45 | 0.26 | 0.24 | 0.01 | 0.03 | 0.01 | 18.5 |
| Солома пшеницы | 0.38 | 0.27 | 0.20 | 0.05 | 0.04 | 0.06 | 17.9 |
| Солома кукурузы | 0.37 | 0.32 | 0.21 | 0.02 | 0.03 | 0.05 | 17.8 |
| Картон | 0.60 | 0.12 | 0.18 | 0 | 0.03 | 0.07 | 17.3 |
*Цел. — целлюлоза; Геми –гемицеллюлозы; Лигн. – лигнин; Прот. – протеины; Экст. – экстрактивные в-ва (смолы, воски) ; Зол. — зольность
Однако прямое сжигание твердых отходов биомассы мало эффективно вследствие недостаточной теплотворной способности, низкой плотности и неоднородности отходов по размерам и составу. С целью улучшения эффективности сгорания отходов биомассы разработана технология их превращения в топливные гранулы.
В настоящее время в мире производится около 40-50 млн тонн гранул в год, а через 5 лет планируется довести их годовое производство до 100 млн тонн. Проблема состоит в том, что в качестве сырья для производства гранул используется преимущественно дефицитная хвойная древесина, и поэтому стоимость гранул относительно высока. К другим недостаткам гранул относится их недостаточно высокая теплотворная способность (на 50% ниже, чем угля). К тому же гранулы являются гидрофильными и следовательно они должны быть изолированы от контакта с влажным воздухом при транспортировке и хранении. Вследствие этого необходима альтернативная технология, которая позволит получать топливные гранулы высокого качества на основе дешевой и распростаненной биомассы, например, соломы кукурузы (СК) или отходов картона (КА).
Одним из способов решения этой проблемы является получение смешанных топливных гранул, содержащих наряду с отходами биомассы также добавки широко распространенных отходов синтетических полимеров, таких как полиэтилен (PE) или полипропилен (PP). Использование гранулированного смешанного топлива позволяет с одной стороны освободить окружающую среду от твердых отходов, а с другой стороны, обеспечивает более высокую теплотворную способность (q) и повышенную плотность тепловой энергии (ED) (Табл. 7). Кроме того, гидрофильность гранул при введении в биомассу гидрофобных полимеров резко снижаеся.
Табл.7. Характеристики гранулированных отходов биомассы и их смесей с отходами полиолефинов (1:1)
| Образец | q, MJ/kg | ED, GJ/m3 | СО2, m3/kg |
| CК | 17.8 | 10.2 | 0 |
| CК/PP | 30.9 | 19.3 | 0.8 |
| PP | 44.0 | 10.8 | 1.6 |
| КА | 17.3 | 10.1 | 0 |
| КА/PE | 30.6 | 19.2 | 0.8 |
| РЕ | 44.0 | 12.0 | 1.6 |
Как известно, биомасса растений считается нейтральной к выделению углекислого газа, поскольку при сжигании биомасса возвращает такое же количество углекислоты, которое было извлечено из атмосферы растением и использовано на биосинтез этой биомассы. Вследствие этого сжигание смешанных топливных гранул приводит к уменьшению выбросов двуокиси углерода вдвое по сравнению с отдельным сжиганием только пластиковых отходов.
Цитируемая литература
[1]. Менделеев Д.И. Основы фабрично-заводской промышленности. Вып. 1. Санкт-Петербург, 1897.
[2]. Parikh J., Channiwala S.A., Ghosal G.K. A correlation for calculating of combustion heat from proximate analysis of solid fuels. Fuel. 2005, vol. 84, 487–494.
[3]. Walters R.N., Lyon R.E., Hackett S.M. Heats of combustion of high-temperature polymers. Fire and Mater. 2000, vol. 24, 1-13.
[4]. Schmidt-Rohr K. Why combustions are always exothermic, yielding about 418 kJ per mole of O2. J. Chem. Educ., 2015, vol. 92, 2094–2099.
Иллюстрация: MyShared.ru